Il est bien connu que dans le dogme central, l'ARN est le médiateur transcriptionnel entre l'ADN et l'expression des protéines.Par rapport à la détection de l'ADN, la détection de l'ARN peut refléter plus objectivement l'expression des gènes dans les organismes.Les expériences impliquant l'ARN comprennent : la qRT-PCR, l'ARN-Seq et la détection de gènes de fusion, etc. Sur la base des caractéristiques de l'ARN lui-même (l'anneau de sucre de l'ARN a un groupe hydroxyle libre de plus que l'anneau de sucre de l'ADN), couplé à un grand nombre de RNases dans l'environnement, l'ARN est plus instable et plus facile à dégrader que l'ADN.Garbage in, garbage out, si la qualité de l'ARN n'est pas bonne, alors les résultats expérimentaux doivent être insatisfaisants, se manifestant spécifiquement par des données inexactes ou une mauvaise répétabilité.Par conséquent, une plus grande attention doit être accordée au traitement de l'ARN, et le lien de contrôle de la qualité est également plus important pour assurer la précision et l'exactitude des données expérimentales ultérieures.
Pour le contrôle qualité de l'ARN, il existe généralement les méthodes couramment utilisées suivantes :
- Spectrophotométrie
- électrophorèse sur gel d'agarose
- Bioanalyseur Agilent
- PCR quantitative fluorescente en temps réel
- Méthode de teinture fluorescente Qubit
01 Spectrophotométrie
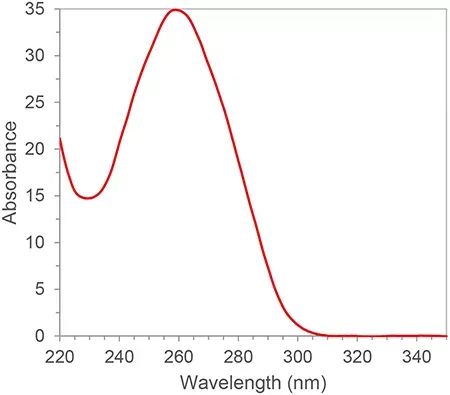
L'ARN a des doubles liaisons conjuguées et a un pic d'absorption à une longueur d'onde de 260 nm.Selon la loi de Lambert-Beer, on peut calculer la concentration d'ARN à partir du pic d'absorption à 260nm.De plus, nous pouvons également calculer la pureté de l'ARN en fonction du rapport des pics d'absorption à 260 nm, 280 nm et 230 nm.280nm et 230nm sont les pics d'absorption des protéines et des petites molécules, respectivement.Le rapport A260/A280 et A260/A230 de pureté d'ARN qualifiée doit être supérieur à 2. S'il est inférieur à 2, cela signifie qu'il y a une contamination par des protéines ou de petites molécules dans l'échantillon d'ARN et doit être purifié à nouveau.Les sources de contamination affecteront les expériences en aval, telles que l'inhibition de l'efficacité d'amplification des réactions PCR, entraînant des résultats quantitatifs inexacts.La pureté de l'ARN a une grande influence sur les résultats ultérieurs, de sorte que la spectrophotométrie est généralement un maillon indispensable du contrôle de la qualité dans la première étape des expériences sur les acides nucléiques.
Figure 1. Spectre d'absorption typique d'ARN/ADN
02 Électrophorèse sur gel d'agarose
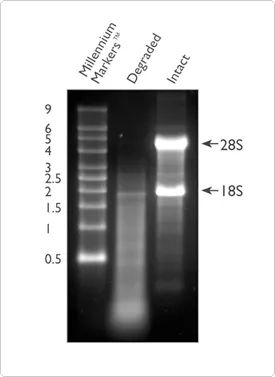
En plus de la pureté, l'intégrité de l'ARN est également l'un des indicateurs importants pour juger de la qualité de l'ARN.La dégradation de l'ARN conduira à un grand nombre de fragments courts dans l'échantillon, de sorte que le nombre de fragments d'ARN pouvant être efficacement détectés et couverts par la séquence de référence sera réduit.L'intégrité de l'ARN peut être vérifiée par électrophorèse de l'ARN total sur un gel d'agarose à 1 %.Cette méthode peut configurer le gel vous-même ou utiliser le système E-Gel™ préfabriqué pour les tests d'intégrité.Plus de 80% de l'ARN total est de l'ARN ribosomique, dont la majorité est composée d'ARNr 28S et 18S (dans les systèmes mammifères).Un ARN de bonne qualité montrera deux barres lumineuses évidentes, qui sont des barres lumineuses 28S et 18S, respectivement, à 5 Kb et 2 Kb, et le rapport aura tendance à être proche de 2:1.S'il est dans un état diffus, cela signifie que l'échantillon d'ARN peut avoir été dégradé, et il est recommandé d'utiliser la méthode décrite plus tard pour tester davantage la qualité de l'ARN.
Figure 2. Comparaison de l'ARN dégradé (piste 2) et intact (piste 3) sur l'électrophorèse sur gel d'agarose
03 Bioanalyseur Agilent
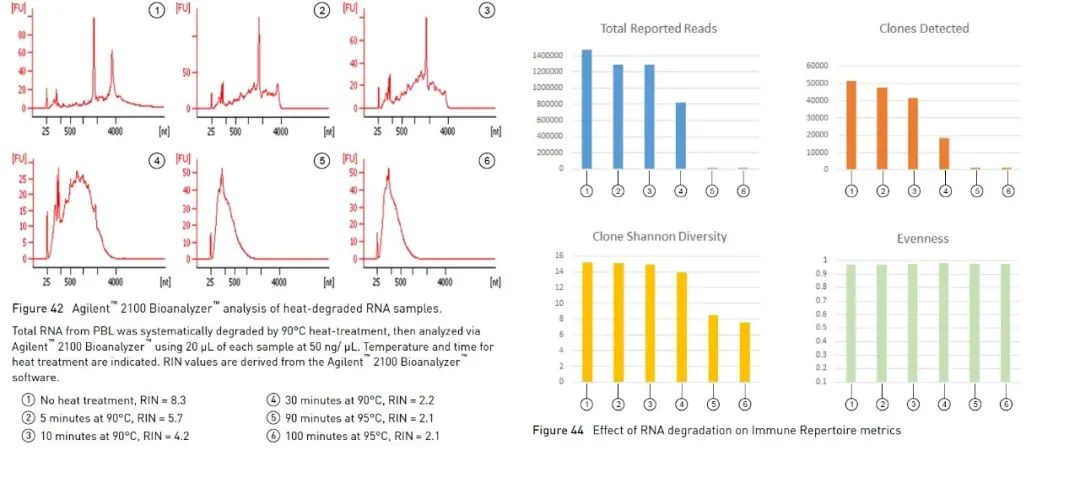
En plus de la méthode d'électrophorèse sur gel d'agarose décrite ci-dessus, qui peut nous aider à identifier l'intégrité de l'ARN simplement et rapidement, nous pouvons également utiliser le bioanalyseur Agilent pour déterminer l'intégrité de l'ARN.Il utilise une combinaison de microfluidique, d'électrophorèse capillaire et de fluorescence pour évaluer la concentration et l'intégrité de l'ARN.En utilisant l'algorithme intégré pour analyser le profil de l'échantillon d'ARN, le bioanalyseur Agilent peut calculer une valeur d'intégrité de l'ARN de référence, le numéro d'intégrité de l'ARN (ci-après dénommé RIN) [1].Plus la valeur de RIN est grande, plus l'intégrité de l'ARN est élevée (1 est extrêmement dégradé, 10 est le plus complet).Certaines expériences impliquant l'ARN suggèrent d'utiliser le RIN comme paramètre d'évaluation de la qualité.En prenant comme exemple des expériences de séquençage à haut débit (ci-après dénommées NGS), les directives d'Oncomine™ Human Immune Repertoire, qui est utilisé pour détecter les récepteurs antigéniques des lymphocytes B et T dans la série de panneaux Oncomine de Thermo Fisher, suggèrent que les échantillons avec des valeurs RIN supérieures à 4, des lectures et des clones plus efficaces peuvent être mesurés (Figure 3).Il existe différentes plages recommandées pour différents panels, et souvent un RIN plus élevé peut apporter des données plus efficaces.
Figure 3, dans les expériences Oncomine™ Human Immune Repertoire, les échantillons avec un RIN supérieur à 4 peuvent détecter des lectures et des clones de lymphocytes T plus efficaces.【2】
Cependant, la valeur RIN présente également certaines limites.Bien que RIN ait une forte corrélation avec la qualité des données expérimentales NGS, il ne convient pas aux échantillons FFPE.Les échantillons FFPE ont été traités chimiquement pendant longtemps et l'ARN extrait a généralement une valeur RIN relativement faible.Cependant, cela ne signifie pas que les données effectives de l'expérience doivent être insatisfaisantes.Pour évaluer avec précision la qualité des échantillons FFPE, nous devons utiliser des mesures autres que RIN.En plus du RIN, le bioanalyseur Agilent peut également calculer la valeur DV200 comme paramètre d'évaluation de la qualité de l'ARN.DV200 est un paramètre qui calcule la proportion de fragments supérieurs à 200 pb dans un échantillon d'ARN.Le DV200 est un meilleur indicateur de la qualité de l'échantillon FFPE que le RIN.Pour l'ARN extrait par FFPE, il a une très forte corrélation avec le nombre de gènes effectivement détectables et la diversité des gènes [3].Bien que le DV200 puisse compenser les lacunes dans la détection de la qualité du FFPE, le bioanalyseur Agilent ne peut toujours pas analyser de manière exhaustive les problèmes de qualité des échantillons d'ARN, y compris la présence ou non d'inhibiteurs dans les échantillons.Les inhibiteurs eux-mêmes peuvent affecter l'efficacité d'amplification des expériences en aval et réduire la quantité de données utiles.Pour savoir s'il y a un inhibiteur dans l'échantillon, nous pouvons adopter la méthode de PCR quantitative fluorescente en temps réel décrite ci-après.
04 PCR quantitative fluorescente en temps réel
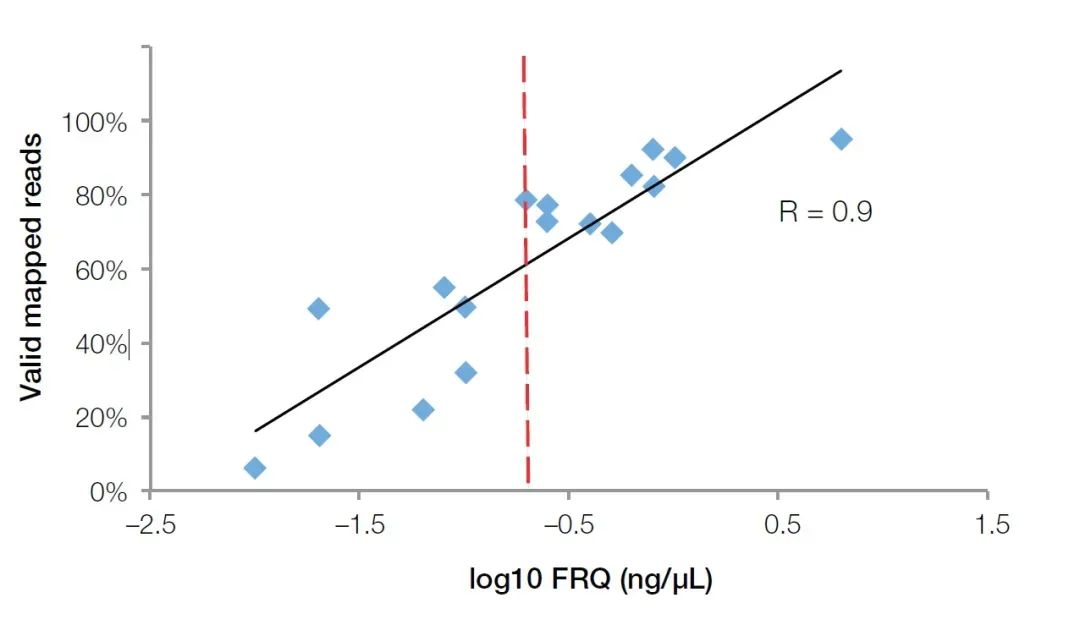
La méthode de PCR quantitative fluorescente en temps réel peut non seulement détecter les inhibiteurs dans l'échantillon, mais également refléter avec précision la qualité de l'ARN dans l'échantillon FFPE.Par rapport aux analyseurs biologiques Agilent, les instruments quantitatifs de fluorescence en temps réel sont plus populaires dans les grands laboratoires biologiques en raison de leur application plus large.Pour tester la qualité des échantillons d'ARN, il nous suffit d'acheter ou de préparer des sondes d'amorce pour les gènes de référence internes, tels que GUSB (Cat no. Hs00939627).En utilisant cet ensemble d'amorces, de sondes et de normes (ARN total de concentration connue) pour mener des expériences quantitatives absolues, la concentration efficace de fragments d'ARN peut être calculée comme la norme d'évaluation de la qualité de l'ARN (Quantification fonctionnelle de l'ARN (FRQ) en abrégé).Dans un test NGS, nous avons constaté que le FRQ des échantillons d'ARN a une très forte corrélation avec le volume de données effectif.Pour tous les échantillons supérieurs à 0,2 ng/uL FRQ, au moins 70 % des lectures peuvent effectivement couvrir la séquence de référence (Figure 4).
Figure 4, la valeur FRQ détectée par la méthode quantitative de fluorescence a une très forte corrélation (R2 > 0,9) avec les données effectives obtenues dans l'expérience NGS.La ligne rouge est la valeur FRQ égale à 0,2 ng/uL (log10 = -0,7).【4】
En plus d'être applicable aux échantillons FFPE, la méthode de PCR quantitative en temps réel peut également surveiller efficacement les inhibiteurs dans les échantillons.Nous pouvons ajouter l'échantillon à détecter dans le système de réaction avec le contrôle positif interne (IPC) et son test, puis effectuer une quantification de la fluorescence pour obtenir la valeur Ct.Si la valeur Ct est en retard par rapport à la valeur Ct dans la réaction sans échantillon, cela indique que l'inhibiteur est présent dans l'échantillon et inhibe l'efficacité de l'amplification dans la réaction.
05 Méthode de teinture fluorescente Qubit
Le fluorimètre Qubit est le petit appareil le plus couramment utilisé pour la détection de la concentration et de la pureté des acides nucléiques, qui est facile à utiliser et existe dans presque tous les laboratoires de biologie moléculaire.Il calcule avec précision la concentration d'acide nucléique en détectant et en colorant fluorescent liant l'acide nucléique (réactif de détection Qubit).Qubit a une sensibilité et une spécificité élevées et peut quantifier avec précision l'ARN jusqu'à une concentration en pg/µL.En plus de la capacité bien connue de quantifier avec précision la concentration d'acide nucléique, le dernier nouveau modèle de Thermo Fisher, Qubit 4.0, peut également détecter l'intégrité de l'ARN.Le système de détection d'ARN du Qubit 4.0 (RNA IQ Assay) détecte l'intégrité de l'ARN en détectant simultanément deux colorants fluorescents spécifiques.Ces deux colorants fluorescents peuvent se lier respectivement à de gros fragments et à de petits fragments d'ARN.Ces deux colorants fluorescents indiquent la proportion de gros fragments d'ARN dans l'échantillon, et à partir de là, la valeur IQ (intégrité et qualité) représentant la qualité de l'ARN peut être calculée.La valeur de QI est applicable aux échantillons FFPE et non FFPE et a une grande influence sur la qualité du séquençage ultérieur.En prenant comme exemple les expériences NGS, dans les expériences de test RNA-Seq réalisées sur la plateforme Ion torrent™, la plupart des échantillons avec des valeurs de QI supérieures à 4 avaient au moins 50 % de lectures efficaces (Figure 5).Comparé aux méthodes de détection mentionnées ci-dessus, Qubit IQ Assay est non seulement plus pratique à utiliser et prend moins de temps (dans les cinq minutes), mais présente également une grande corrélation entre la valeur de QI du paramètre mesuré et la qualité des données des expériences en aval.
Figure 5, il existe une grande corrélation entre la valeur Qubit RNA IQ et les lectures cartographiées de RNA-Seq.【5】
Grâce à l'introduction ci-dessus, je crois que tout le monde a une compréhension suffisante des différentes méthodes de contrôle de la qualité de l'ARN.En pratique, vous pouvez choisir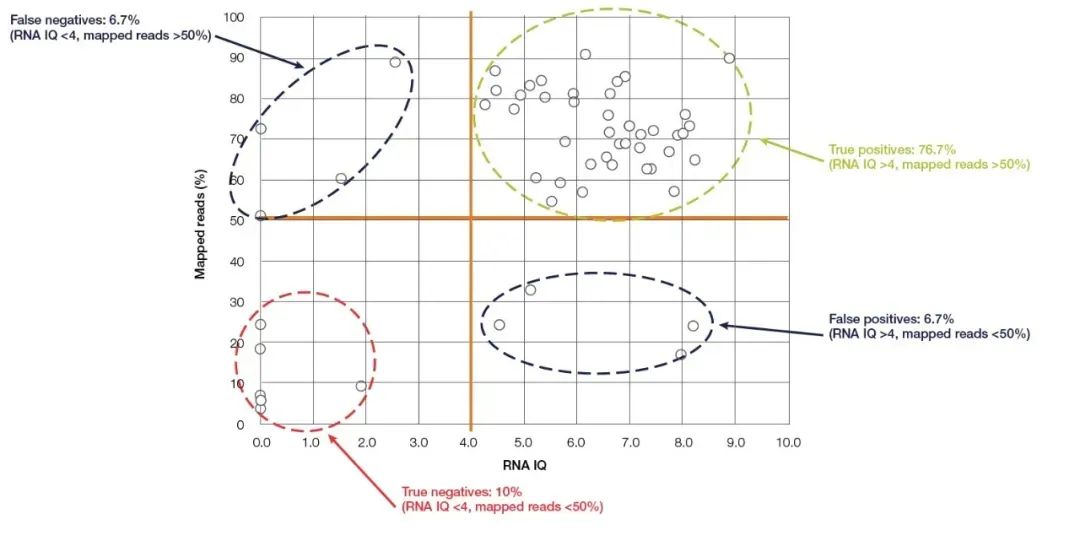 la méthode correspondante selon le type d'échantillon et les instruments existants.Ce n'est qu'en contrôlant bien la qualité de l'ARN que nous pouvons éviter l'échec des expériences ultérieures causées par une mauvaise qualité de l'échantillon, économisant ainsi un temps précieux, de l'énergie et des coûts.
la méthode correspondante selon le type d'échantillon et les instruments existants.Ce n'est qu'en contrôlant bien la qualité de l'ARN que nous pouvons éviter l'échec des expériences ultérieures causées par une mauvaise qualité de l'échantillon, économisant ainsi un temps précieux, de l'énergie et des coûts.
Produits de référence :
Kit d'isolement d'ARN total animal
Kit d'isolement d'ARN total cellulaire
les références
【1】Schroeder, A., Mueller, O., Stocker, S. et al.Le RIN : un numéro d'intégrité de l'ARN permettant d'attribuer des valeurs d'intégrité aux mesures d'ARN.BMC Molecular Biol 7, 3 (2006).https:// doi.org/10.1186/1471-21 99-7-3
【2】Oncomine Human Immune Repertoire User Guide (Pub. No. MAN0017438 Rev. C.0).
【3】Leah C Wehmas, Charles E Wood, Brian N Chorley, Carole L Yauk, Gail M Nelson, Susan D Hester, Mesures de qualité améliorées pour l'évaluation de l'ARN dérivé d'échantillons de tissus d'archives fixés au formol, sciences toxicologiques, volume 170, numéro 2, août 2019, pages 357–373,https://doi.org/10.1093/toxsci/
Heure de publication : 12 juin 2023