Qu'est-ce qu'un vaccin à ARNm
Le vaccin à ARNm transfère l'ARN aux cellules du corps pour exprimer et produire des antigènes protéiques après des modifications pertinentes in vitro, amenant ainsi le corps à produire une réponse immunitaire contre l'antigène, augmentant ainsi la capacité immunitaire du corps[1,3].
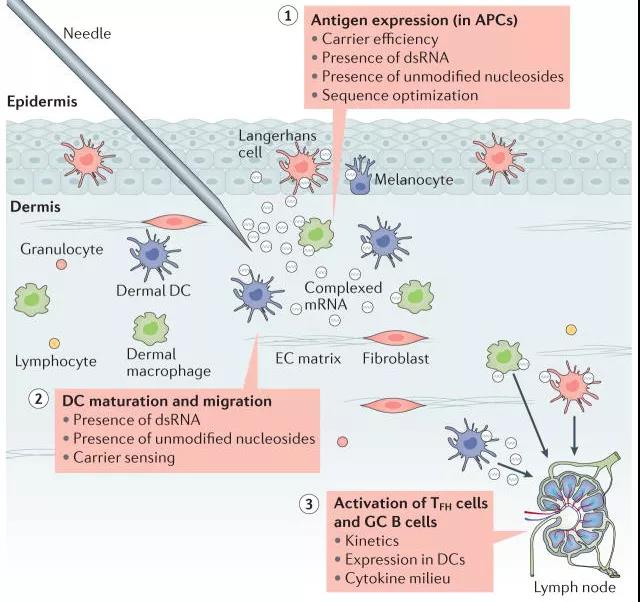
Figure 1 : Diagramme schématique de l'effet de l'injection directe de vaccin à ARNm [2]
Classification des vaccins à ARNm
Les vaccins à ARNm sont divisés en deux types :non réplicatifARNm etauto-amplifiéARNm: l'ARNm auto-amplifiant non seulement code l'antigène cible, mais code également la réplication qui permet l'amplification intracellulaire de l'ARN et le mécanisme d'expression des protéines.Les vaccins à ARNm non réplicatifs ne codent que pour les antigènes cibles et contiennent des régions 5' et 3' non traduites (UTR).Ils fournissent une stimulation complète de l'adaptabilité et de l'immunité innée, à savoir l'expression antigénique in situ et la transmission des signaux de danger, et ont les applications suivantes[2,3]
●Peut fournir une stimulation complète de l'adaptabilité et de l'immunité innée, à savoir l'expression antigénique in situ et la transmission des signaux de danger
●Peut induire une réponse immunitaire "équilibrée", incluant des effecteurs humoraux et cellulaires et une mémoire immunitaire
●Peut combiner différents antigènes sans augmenter la complexité de la formulation du vaccin
● Une amélioration continue du potentiel immunitaire peut être obtenue grâce à une vaccination répétée, et il n'y a pas ou peu de réponse immunitaire au porteur
● Les vaccins à ARNm thermostables peuvent simplifier le transport et le stockage des vaccins
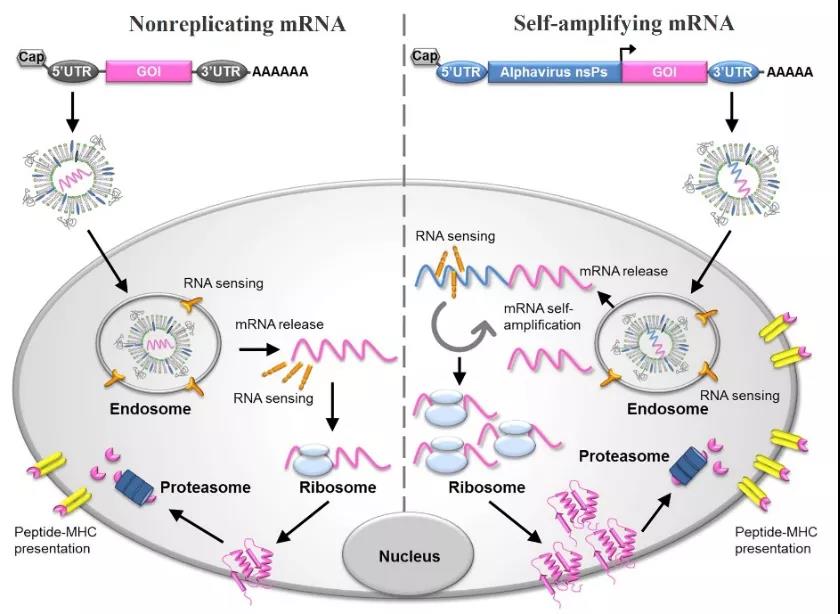
Figure 2 : Diagramme schématique du vaccin à ARNm et de son mécanisme d'expression antigénique [4]
Caractéristiques des vaccins à ARNm
Par rapport aux vaccins traditionnels, les vaccins à ARNm ont des processus de production simples, des vitesses de développement rapides, aucun besoin de culture cellulaire et un faible coût.Par rapport aux vaccins à ADN, les vaccins à ARNm n'ont pas besoin de pénétrer dans le noyau et il n'y a aucun risque d'intégration dans le génome de l'hôte.La demi-vie peut être ajustée par modification.
Tableau 1 : Avantages et inconvénients des vaccins à ARNm
|
| Avantage | Défaut |
| vaccin ARNm | Recherche et développement rapides, la production de vaccins ne prend que 40 jours | Déclencher une réponse immunitaire inutile
|
| Instabilité de l'ARNm dans des conditions physiologiques, facile à dégrader | Ne s'intégrera pas dans le génome pour éviter d'éventuelles mutations thérapeutiques
| |
| Pas besoin de signal de localisation nucléaire, transcription | L'efficacité de la sûreté nucléaire reste à vérifier
|
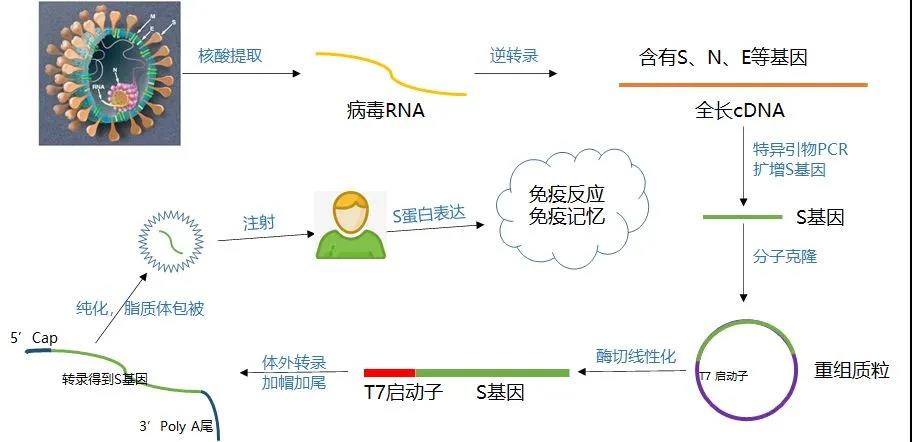
Figure 3 : Organigramme de la production et de la préparation du vaccin à ARNm [4]
Kit d'isolement d'ARN viral Foregene
RT-qPCR facile (une étape)
Stratégies améliorées pour la préparation de vaccins à ARNm
En raison de la faible stabilité de l'ARNm lui-même, de la dégradation facile par les nucléases dans les tissus, de la faible efficacité d'entrée dans les cellules et de la faible efficacité de traduction, ces défauts limitent l'application des vaccins à ARNm.L'efficacité de la traduction joue également un rôle très critique.Les véhicules de livraison peuvent être divisés en vecteurs viraux et en vecteurs non viraux (y compris les liposomes, les non-liposomes, les virus, les nanoparticules, etc.).Par conséquent, des mesures d'amélioration pertinentes sont nécessaires.Ce qui suit est une stratégie d'amélioration pharmacologique pour la préparation d'ARNm[2]
1 Synthétiser des analogues de coiffe ou utiliser des enzymes de coiffage pour stabiliser l'ARNm et augmenter la traduction des protéines en se liant au facteur d'initiation de la traduction eucaryote 4E (EIF4E)
2 Ajustez les éléments dans la région 5′ non traduite (UTR) et 3′-UTR pour stabiliser l'ARNm et augmenter la traduction des protéines
3 L'ajout de la queue Poly(A) peut stabiliser l'ARNm et augmenter la traduction des protéines
4 Nucléosides modifiés pour réduire l'activation immunitaire innée et augmenter la traduction
5 Le traitement avec la RNase III et la purification par chromatographie liquide rapide des protéines (FPLC) peuvent réduire l'activation immunitaire et augmenter la traduction
6 Optimiser les séquences ou les codons pour augmenter la traduction
7 Co-administration de facteurs d'initiation de la traduction et d'autres méthodes pour modifier la traduction et l'immunogénicité
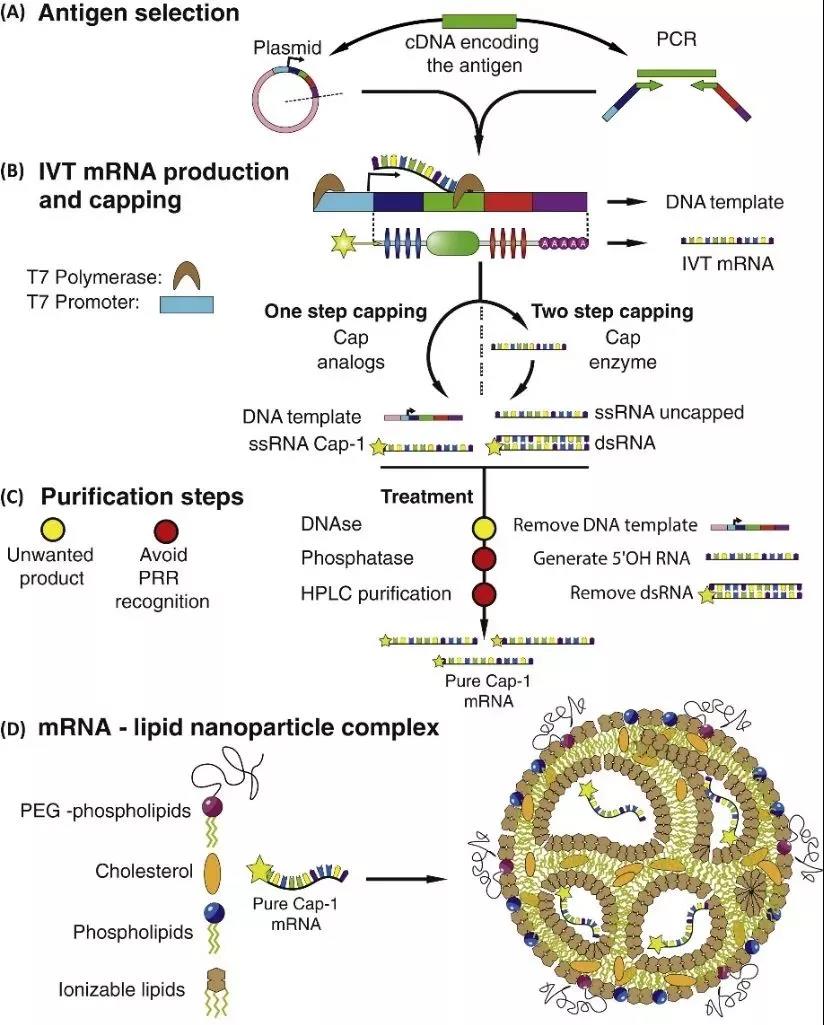
Figure 4 : Processus de production et d'assemblage d'ARNm de transcription in vitro (IVT) [5]
Préparation à grande échelle d'ADN plasmidique
La purification de l'ADN plasmidique élimine principalement les contaminants tels que l'ARN, l'endotoxine d'ADN à cercle ouvert, la protéine hôte et l'acide nucléique hôte, et transforme généralement le plasmide recombinant en E. coli.E. coli subit une fermentation à haute densité, puis une séparation solide-liquide et une collecte d'E. coli.Les E. coli sont ensuite soumis à une lyse alcaline, une séparation solide-liquide centrifuge et une clarification par microfiltration après lyse, une ultrafiltration et une concentration après clarification, puis une purification chromatographique.

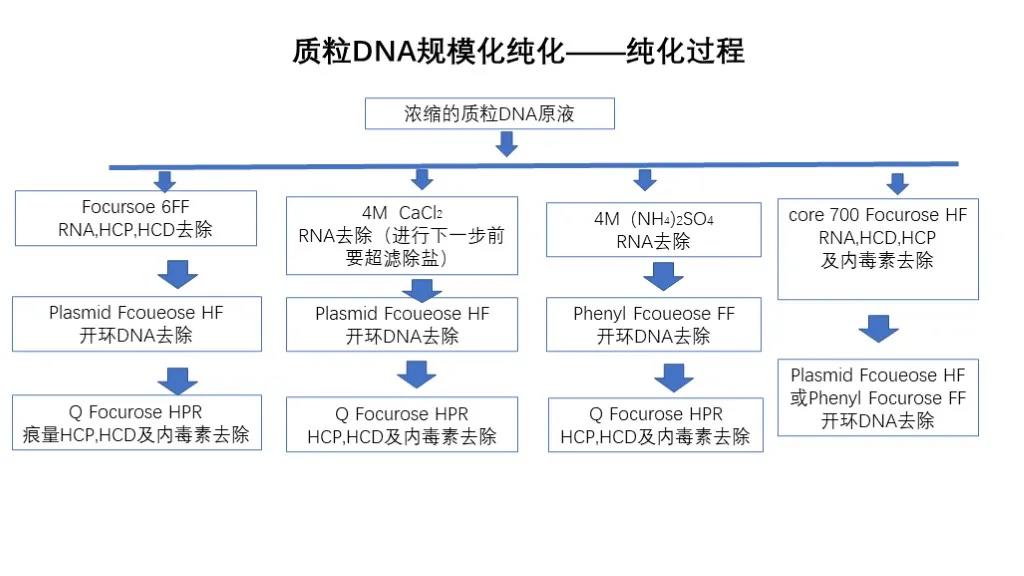
Purification de l'ADN plasmidique :
Foregene General Plasmid Mini Kit
【1】苗鹤凡, 郭勇, 江新香.ARNm疫苗研究进展及挑战[J].免疫学杂志, 2016(05):446-449.
【2】Pardi N , Hogan MJ , Porter FW , et al.Les vaccins à ARNm — une nouvelle ère en vaccinologie[J].La nature examine la découverte de médicaments, 2018.
【3】Kramps T., Elbers K. (2017) Introduction aux vaccins à ARN.Dans : Kramps T., Elbers K. (eds) RNA Vaccines.Méthodes en biologie moléculaire, vol 1499. Humana Press, New York, NY.
【4】Maruggi G, Zhang C, Li J, et al.L'ARNm en tant que technologie transformatrice pour le développement de vaccins pour contrôler les maladies infectieuses [J].Thérapie moléculaire, 2019.
【5】Sergio Linares-Fernández, Céline Lacroix,, Adapter le vaccin à ARNm pour équilibrer la réponse immunitaire innée/adaptative, Tendances en médecine moléculaire, Volume 26, Numéro 3, 2020, Pages 311-323.
Heure de publication : 05 août 2021








