Établir l'expérience PCR SOP pour normaliser le comportement du personnel de l'expérience.

L'expérimentateur respecte strictement les procédures opératoires et minimise la pollution PCR qui peut être causée par des facteurs humains ou prévient l'apparition de la pollution.En outre, l'expérimentateur doit posséder les connaissances et compétences professionnelles correspondantes, notamment la maîtrise de l'utilisation des équipements connexes, la clarification de l'ensemble du processus de travail, la maîtrise des méthodes de traitement de la contamination et des méthodes de contrôle de la qualité en laboratoire, et la capacité d'interpréter correctement les résultats des tests.
Mettre en place un laboratoire PCR standard.

Le laboratoire PCR est divisé en quatre zones en principe, à savoir la zone de préparation des réactifs, la zone de traitement des échantillons, la zone d'amplification et la zone d'analyse des produits d'amplification.Les deux premières zones sont des zones de pré-amplification, et les deux dernières zones sont des zones de post-amplification.La zone de pré-amplification et la zone de post-amplification doivent être strictement séparées.Les matériaux expérimentaux, les réactifs, le papier d'enregistrement, les stylos, les matériaux de nettoyage, etc., ne peuvent circuler que de la zone de pré-amplification à la zone de post-amplification, c'est-à-dire de la zone de préparation des réactifs → zone de traitement des échantillons → zone d'amplification → zone d'analyse des produits d'amplification, et ne doivent pas refluer .Le flux d'air dans le laboratoire doit également s'écouler de la zone de pré-amplification vers la zone de post-amplification, et non revenir en arrière.La conception idéale du laboratoire de PCR est illustrée ci-dessous :
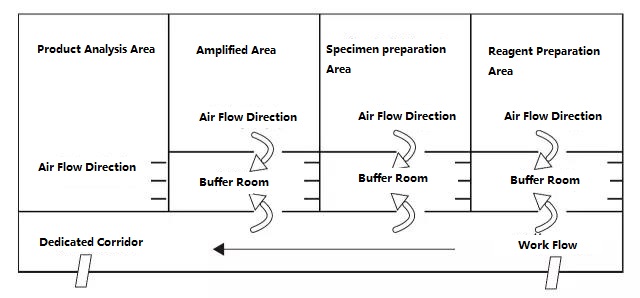
Figure A : Mode de configuration idéal du laboratoire PCR avec pression négative dans la salle tampon
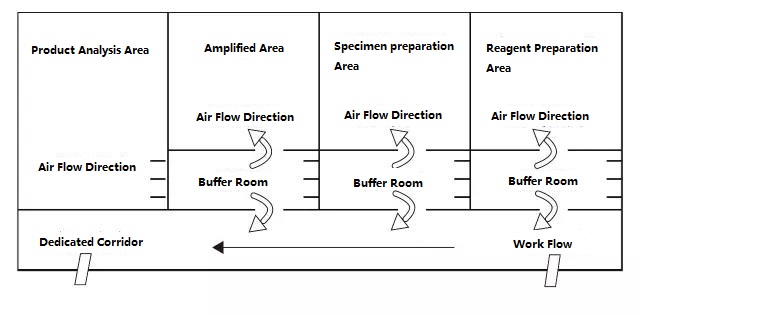
Figure B : Mode de configuration idéal du laboratoire PCR avec pression positive dans la salle tampon
Les schémas de configuration du laboratoire PCR donnés dans la figure A et la figure B devraient être un mode de configuration plus idéal, et le laboratoire avec des conditions peut se référer à ce mode pour la conception.Pour les laboratoires ordinaires, il est recommandé que la zone d'amplification PCR et la zone d'analyse du produit puissent être séparées, et l'ouverture du couvercle doit être réduite autant que possible dans la zone de préparation des échantillons et la zone d'amplification PCR.Rappel : Il est strictement interdit d'amener les produits et fournitures expérimentales dans la zone d'analyse des produits vers la zone de préparation des échantillons et la zone d'amplification PCR.

Si le laboratoire n'effectue que la détection et l'identification par PCR, il est recommandé d'utiliser la PCR quantitative fluorescente au lieu de la PCR conventionnelle.
Les résultats de détection PCR quantitative de fluorescence peuvent être collectés et analysés par des signaux de fluorescence, il n'est donc pas nécessaire d'ouvrir le couvercle pour l'électrophorèse après la réaction, ce qui évite la contamination des produits PCR causée par la fuite des produits de réaction pour former des aérosols.Si vous augmentez le nombre d'ouvertures de bouchons pendant l'étape de chargement de l'électrophorèse sur gel, une contamination par aérosol est susceptible de se produire.Il est recommandé de favoriser l'application de la PCR quantitative et de remplacer progressivement la PCR qualitative.
Le système de contamination des produits anti-PCR UNG est utilisé pour la réaction PCR.
Le système utilise dUTP au lieu de dTTP.Après la réaction PCR, tous les produits PCR (fragments d'ADN) sont incorporés avec du dUTP ;lors du cycle suivant de réaction PCR, l'enzyme UNG ajoutée au système est incubée à 37 ° C pendant 5 minutes avant la PCR, ce qui peut dégrader spécifiquement tous les fragments d'ADN contenant du dUTP, puis effectuer une réaction PCR.Cela peut éliminer complètement la contamination par aérosol causée par les produits PCR.L'effet est illustré dans la figure ci-dessous :
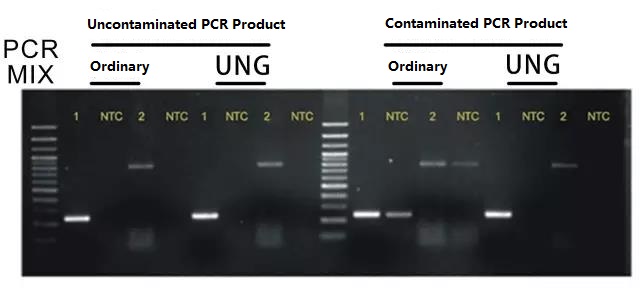
Remarque : Pour la série PCR directe, vous pouvez choisir les produits de la série du système de contamination des produits anti-PCR de ForegeneSuggérer
Pour les laboratoires qui effectuent des tests de génotypage à grande échelle, il est fortement recommandé d'utiliser le système de contamination des produits anti-PCR UNG pour tester les réactifs en plus de la construction de laboratoires raisonnables.
Rappel : L'utilisation de ce système ne peut pas éliminer la contamination du produit PCR qui a déjà été causée.Par conséquent, le système UNG doit être utilisé au début du test concerné, et le système UNG doit être utilisé pour l'amplification PCR, afin d'éviter la contamination des produits PCR faux positifs.
Il est recommandé d'utiliser le système Direct PCR-UNG de Foregene lors de la réalisation de tests à grande échelle, tels que :
Kit de PCR directe de feuille de plante-UNG ;
Kit de PCR directe de semences de plantes-UNG ;
Kit de PCR directe de tissus animaux-UNG ;
Kit de PCR directe de queue de souris-UNG ;
Zebra Fish Direct PCR Kit-UNG。
Cette série de kits de Foregenepeut non seulement effectuer une détection PCR rapidement et à grande échelle, mais également prévenir et contrôler efficacement la contamination des produits PCR.
Heure de publication : 19 mars 2021








