Les anticorps, également appelés immunoglobulines (Ig), sont des glycoprotéines qui se lient spécifiquement aux antigènes.
La préparation conventionnelle d'anticorps est produite en immunisant des animaux et en recueillant l'antisérum.Par conséquent, l'antisérum contient généralement des anticorps dirigés contre d'autres antigènes non apparentés et d'autres composants protéiques du sérum.Les molécules d'antigène générales contiennent principalement plusieurs épitopes différents, de sorte que les anticorps conventionnels sont également un mélange d'anticorps dirigés contre plusieurs épitopes différents.Même les anticorps sériques classiques dirigés contre le même épitope sont toujours composés d'anticorps hétérogènes produits par différents clones de lymphocytes B.Par conséquent, les anticorps sériques conventionnels sont également appelés anticorps polyclonaux ou anticorps polyclonaux en abrégé.
L'anticorps monoclonal (anticorps monoclonal) est un anticorps hautement uniforme produit par un seul clone de cellule B et uniquement dirigé contre un épitope spécifique.Il est généralement préparé par la technologie des hybridomes - la technologie des anticorps d'hybridome est basée sur la technologie de fusion cellulaire, combinant des cellules B avec la capacité de sécréter des anticorps spécifiques et des cellules de myélome avec une capacité de croissance infinie dans des hybridomes de cellules B .Cette cellule d'hybridome a les caractéristiques d'une cellule mère.Il peut proliférer indéfiniment et immortellement in vitro comme les cellules de myélome, et il peut synthétiser et sécréter des anticorps spécifiques comme les lymphocytes spléniques.Par clonage, une lignée monoclonale dérivée d'une seule cellule d'hybridome, c'est-à-dire une lignée cellulaire d'hybridome, peut être obtenue.Les anticorps qu'il produit sont des anticorps hautement homogènes dirigés contre le même déterminant antigénique, c'est-à-dire des anticorps monoclonaux.
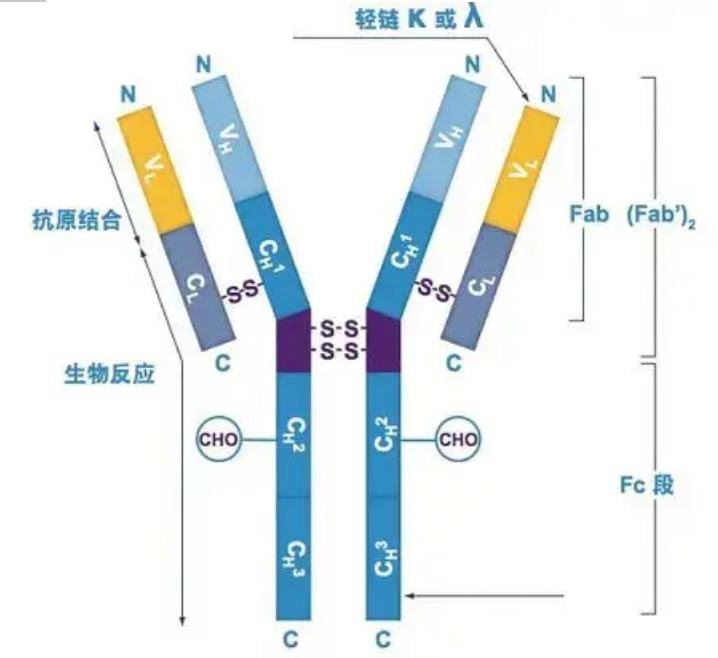
Les anticorps existent sous la forme d'un ou plusieurs monomères en forme de Y (c'est-à-dire des anticorps monoclonaux ou des anticorps polyclonaux).Chaque monomère en forme de Y est composé de 4 chaînes polypeptidiques, dont deux chaînes lourdes identiques et deux chaînes légères identiques.La chaîne légère et la chaîne lourde sont nommées en fonction de leur poids moléculaire.Le sommet de la structure en forme de Y est la région variable, qui est le site de liaison à l'antigène.(Extrait de Detai Bio-Monoclonal Antibody Concept)
Structure des anticorps
 Chaîne lourde
Chaîne lourde
Il existe cinq types de chaînes lourdes d'Ig de mammifères, nommées avec les lettres grecques α, δ, ε, γ et μ.Les anticorps correspondants sont appelés IgA, IgD, IgE, IgG et IgM.Différentes chaînes lourdes diffèrent par leur taille et leur composition.α et γ contiennent environ 450 acides aminés, tandis que μ et ε contiennent environ 550 acides aminés.
Chaque chaîne lourde a deux régions : la région constante et la région variable.Tous les anticorps du même type ont la même région constante, mais il existe des différences entre les anticorps de différents types.Les régions constantes des chaînes lourdes γ, α et δ sont composées de trois domaines Ig en tandem, avec une région charnière pour augmenter sa flexibilité ;les régions constantes des chaînes lourdes μ et ε sont composées de 4 domaines Ig.La région variable de la chaîne lourde de l'anticorps produite par différentes cellules B est différente, mais la région variable de l'anticorps produit par la même cellule B ou le même clone cellulaire est la même, et la région variable de chaque chaîne lourde a une longueur d'environ 110 acides aminés., Et forment un seul domaine Ig.
Chaîne légère
Il n'y a que deux types de chaînes légères chez les mammifères : le type lambda et le type kappa.Chaque chaîne légère a deux domaines liés : une région constante et une région variable.La longueur de la chaîne légère est d'environ 211 à 217 acides aminés.Les deux chaînes légères contenues dans chaque anticorps sont toujours les mêmes.Pour les mammifères, la chaîne légère de chaque anticorps n'a qu'un seul type : kappa ou lambda.Chez certains vertébrés inférieurs, tels que les poissons cartilagineux (poissons cartilagineux) et les poissons osseux, on trouve également d'autres types de chaînes légères telles que le type iota (iota).
Segments Fab et Fc
Le segment Fc peut être directement combiné avec des enzymes ou des colorants fluorescents pour marquer les anticorps.C'est la partie où l'anticorps se fixe sur la plaque pendant le processus ELISA, et c'est aussi la partie où le deuxième anticorps est reconnu et lié dans l'immunoprécipitation, l'immunotransfert et l'immunohistochimie.Les anticorps peuvent être hydrolysés en deux segments F(ab) et un segment Fc par des enzymes protéolytiques telles que la papaïne, ou ils peuvent être séparés de la région charnière par la pepsine et hydrolysés en un segment F(ab)2 et un segment Fc.Les fragments d'anticorps IgG sont parfois très utiles.En raison de l'absence du segment Fc, le segment F(ab) ne précipitera pas avec l'antigène et ne sera pas non plus capturé par les cellules immunitaires dans les études in vivo.En raison des petits fragments moléculaires et de l'absence de fonction de réticulation (due à l'absence de segment Fc), le segment Fab est généralement utilisé pour le radiomarquage dans les études fonctionnelles, et le segment Fc est principalement utilisé comme agent bloquant dans la coloration histochimique.
Régions variables et constantes
La région variable (région V) est située à 1/5 ou 1/4 (contenant environ 118 résidus d'acides aminés) de la chaîne H près de l'extrémité N-terminale et à 1/2 (contenant environ 108-111 résidus d'acides aminés) près de l'extrémité N-terminale de la chaîne L.Chaque région V a un cycle peptidique formé par des liaisons disulfure intra-chaîne, et chaque cycle peptidique contient environ 67 à 75 résidus d'acides aminés.La composition et la disposition des acides aminés dans la région V déterminent la spécificité de liaison à l'antigène de l'anticorps.En raison des types et de la séquence d'acides aminés en constante évolution dans la région V, de nombreux types d'anticorps avec différentes spécificités d'antigène de liaison peuvent être formés.Les régions V de la chaîne L et de la chaîne H sont respectivement appelées VL et VH.Dans VL et VH, la composition en acides aminés et la séquence de certaines régions locales ont un degré de variation plus élevé.Ces régions sont appelées régions hypervariables (HVR).La composition en acides aminés et la disposition des parties non-HVR dans la région V sont relativement conservatrices, ce qu'on appelle la région de charpente.Il existe trois régions hypervariables dans VL, généralement situées respectivement aux résidus d'acides aminés 24 à 34 et 89 à 97.Les trois HVR de VL et VH sont respectivement appelés HVR1, HVR2 et HVR3.La recherche et l'analyse de la diffraction des cristaux de rayons X ont prouvé que la région hypervariable est bien l'endroit où l'antigène de l'anticorps se lie, on l'appelle donc la région déterminant la complémentarité (CDR).Les HVR1, HVR2 et HVR3 de VL et VH peuvent être appelés respectivement CDR1, CDR2 et CDR3.Généralement, CDR3 a un degré plus élevé d'hypervariabilité.La région hypervariable est également le lieu principal où existent les déterminants idiotypiques des molécules d'Ig.Dans la plupart des cas, la chaîne H joue un rôle plus important dans la liaison à l'antigène.
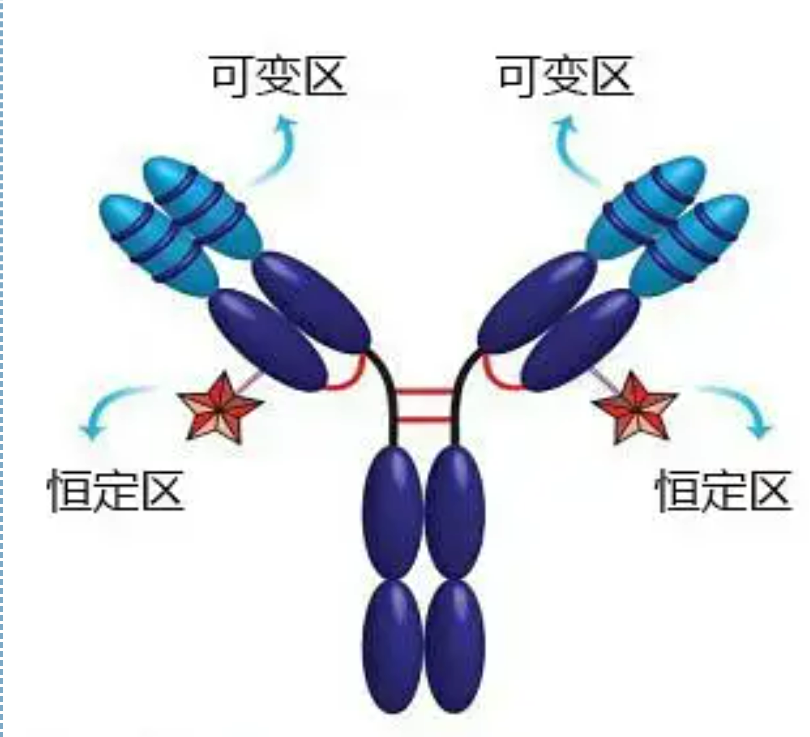 La région constante (région C)est situé aux 3/4 ou 4/5 (approximativement de l'acide aminé 119 à l'extrémité C) de la chaîne H près de l'extrémité C et à 1/2 (contient environ 105 résidus d'acides aminés) près de l'extrémité C de la chaîne L.Chaque région fonctionnelle de la chaîne H contient environ 110 résidus d'acides aminés et contient un cycle peptidique composé de 50 à 60 résidus d'acides aminés reliés par des liaisons disulfure.La composition et l'arrangement en acides aminés de cette région sont relativement constants dans la même chaîne animale d'isotype L d'Ig et dans la même chaîne de type H.De même, il ne peut se lier spécifiquement qu'à l'antigène correspondant, mais la structure de sa région C est la même, c'est-à-dire qu'elle a la même antigénicité.L'anticorps secondaire anti-IgG humaine de cheval (ou anti-anticorps) peut être combiné avec les deux. Une combinaison d'anticorps (IgG) contre différentes exotoxines se produit.C'est une base importante pour préparer des anticorps secondaires et appliquer de la fluorescéine, des isotopes, des enzymes et d'autres anticorps marqués.
La région constante (région C)est situé aux 3/4 ou 4/5 (approximativement de l'acide aminé 119 à l'extrémité C) de la chaîne H près de l'extrémité C et à 1/2 (contient environ 105 résidus d'acides aminés) près de l'extrémité C de la chaîne L.Chaque région fonctionnelle de la chaîne H contient environ 110 résidus d'acides aminés et contient un cycle peptidique composé de 50 à 60 résidus d'acides aminés reliés par des liaisons disulfure.La composition et l'arrangement en acides aminés de cette région sont relativement constants dans la même chaîne animale d'isotype L d'Ig et dans la même chaîne de type H.De même, il ne peut se lier spécifiquement qu'à l'antigène correspondant, mais la structure de sa région C est la même, c'est-à-dire qu'elle a la même antigénicité.L'anticorps secondaire anti-IgG humaine de cheval (ou anti-anticorps) peut être combiné avec les deux. Une combinaison d'anticorps (IgG) contre différentes exotoxines se produit.C'est une base importante pour préparer des anticorps secondaires et appliquer de la fluorescéine, des isotopes, des enzymes et d'autres anticorps marqués.
Produits connexes:
Kit Cell Direct RT-qPCR
Heure de publication : 30 septembre 2021








